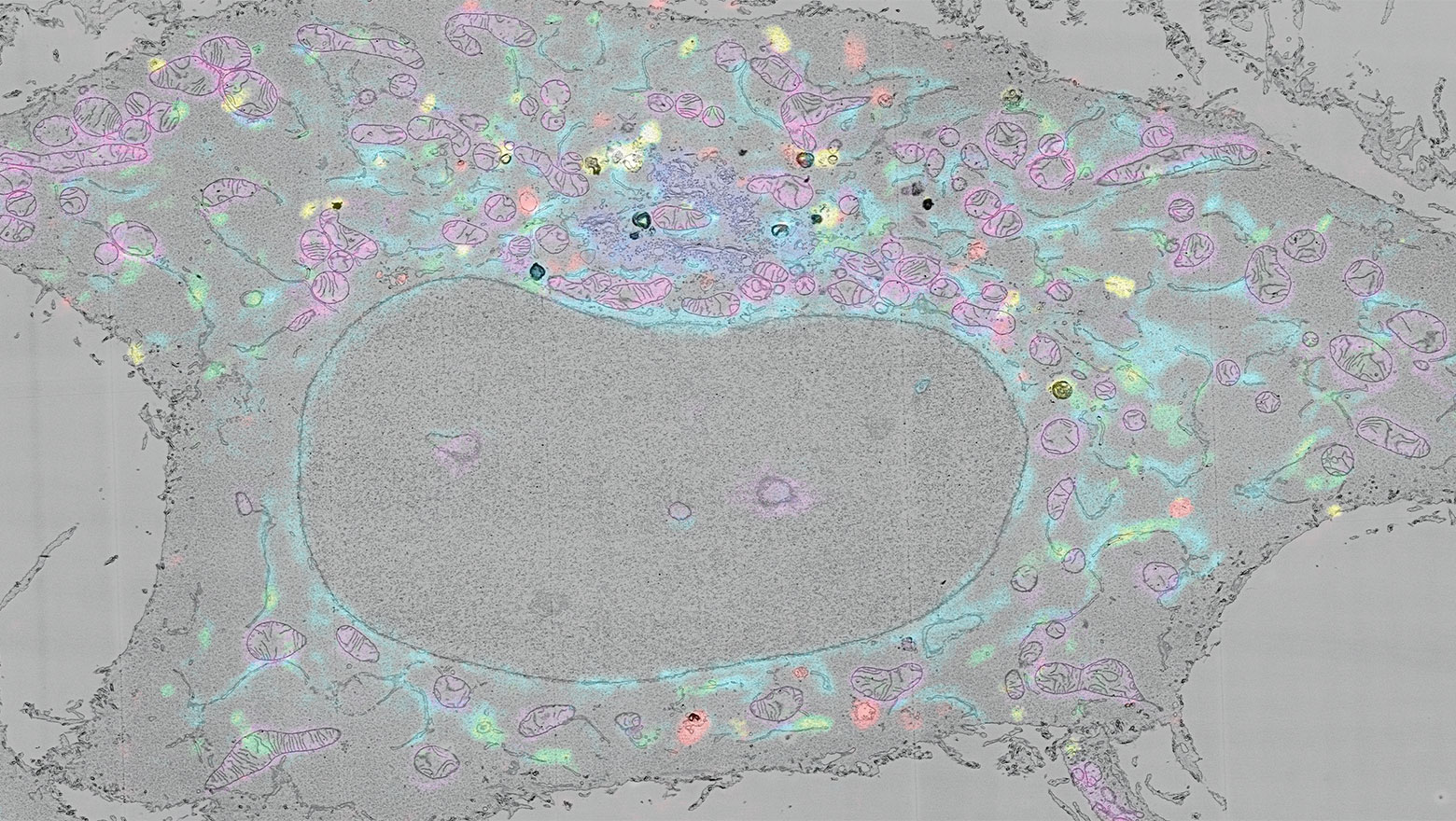
生命科学を支える 細胞生物学
News / Topics
新着お知らせ
-
CSF論文発表のお知らせ
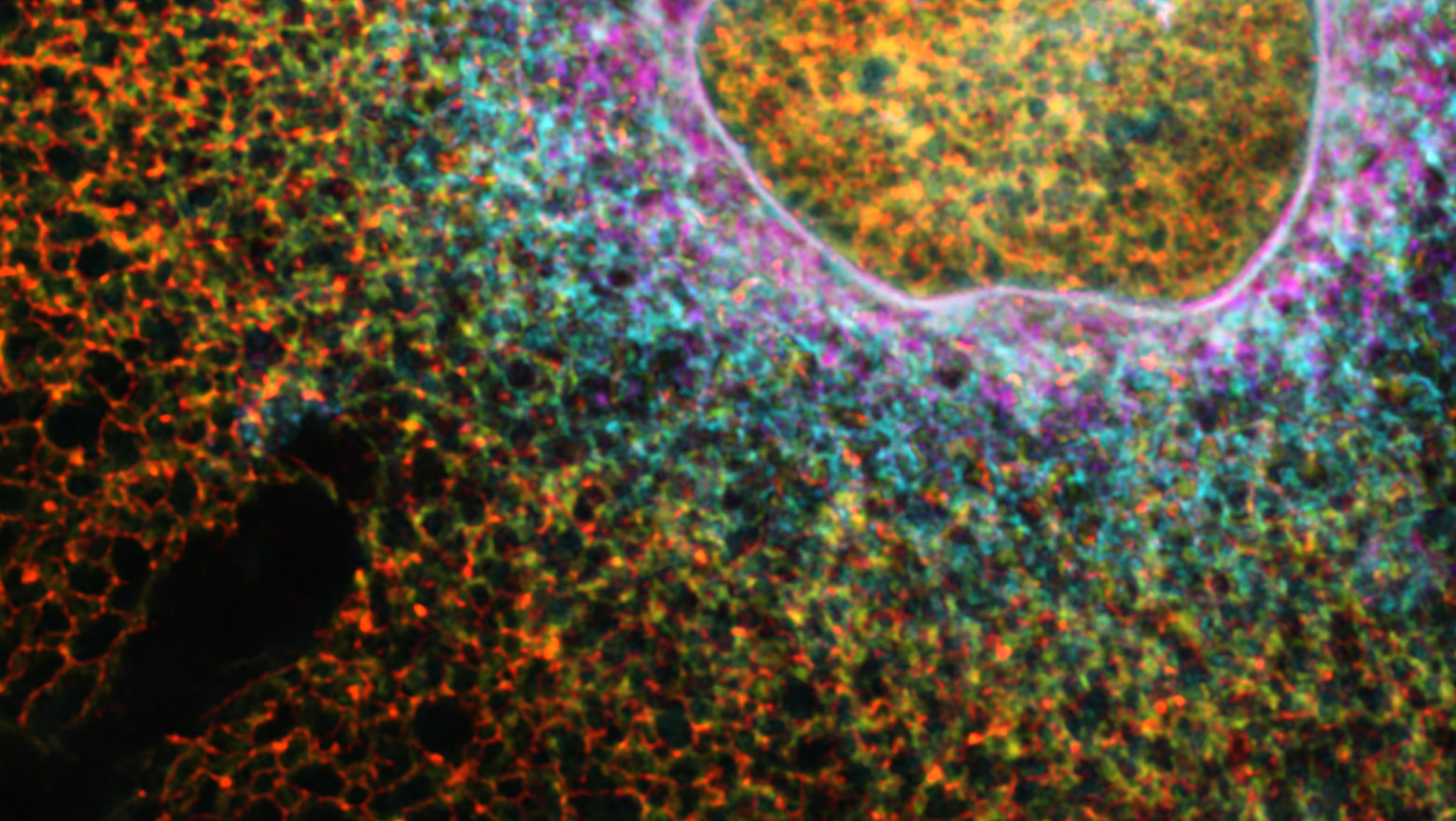
Emerging S100A11 roles: Regulation of focal adhesion dynamics and mechanosensing
本論文は、S100タンパク質ファミリータンパク質S100A11の多様な機能をレビューし、特に細胞接着斑のメカノセンスレギュレーターとしての新たな役割を強調している。
-
CSF論文発表のお知らせ
Depletion of Flot1 attenuates macropinosome-dependent mTORC1 activation in podocytes
-
CSF論文発表のお知らせ
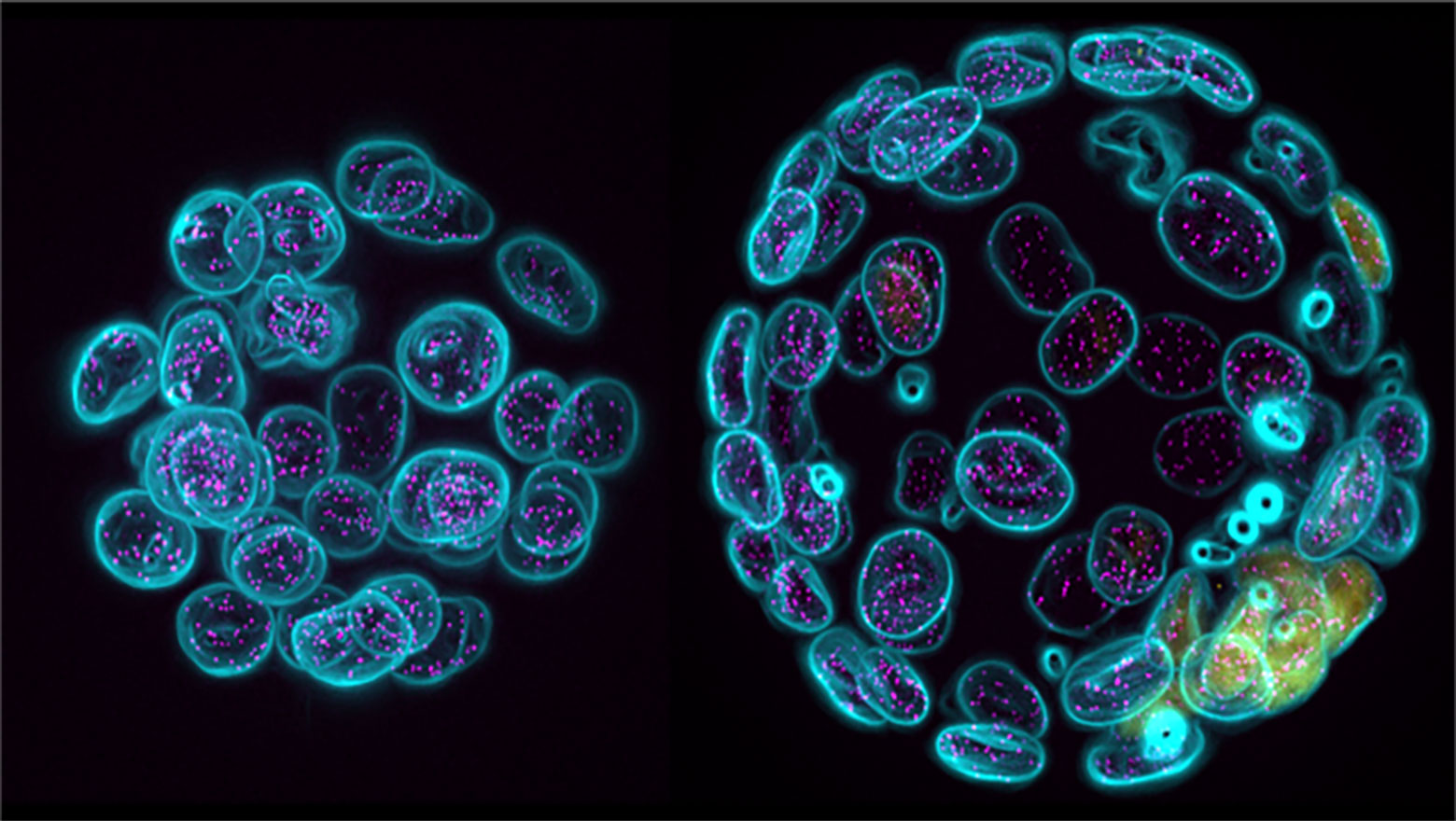
Enhanced release of ciliary extracellular vesicles suppresses cell migration and promotes cell aggregation
この論文では、孤立状態から増殖した膵がん細胞で見られる一次繊毛由来細胞外小胞の放出増加の機能的意義を解析した。
-
CSF論文発表のお知らせ
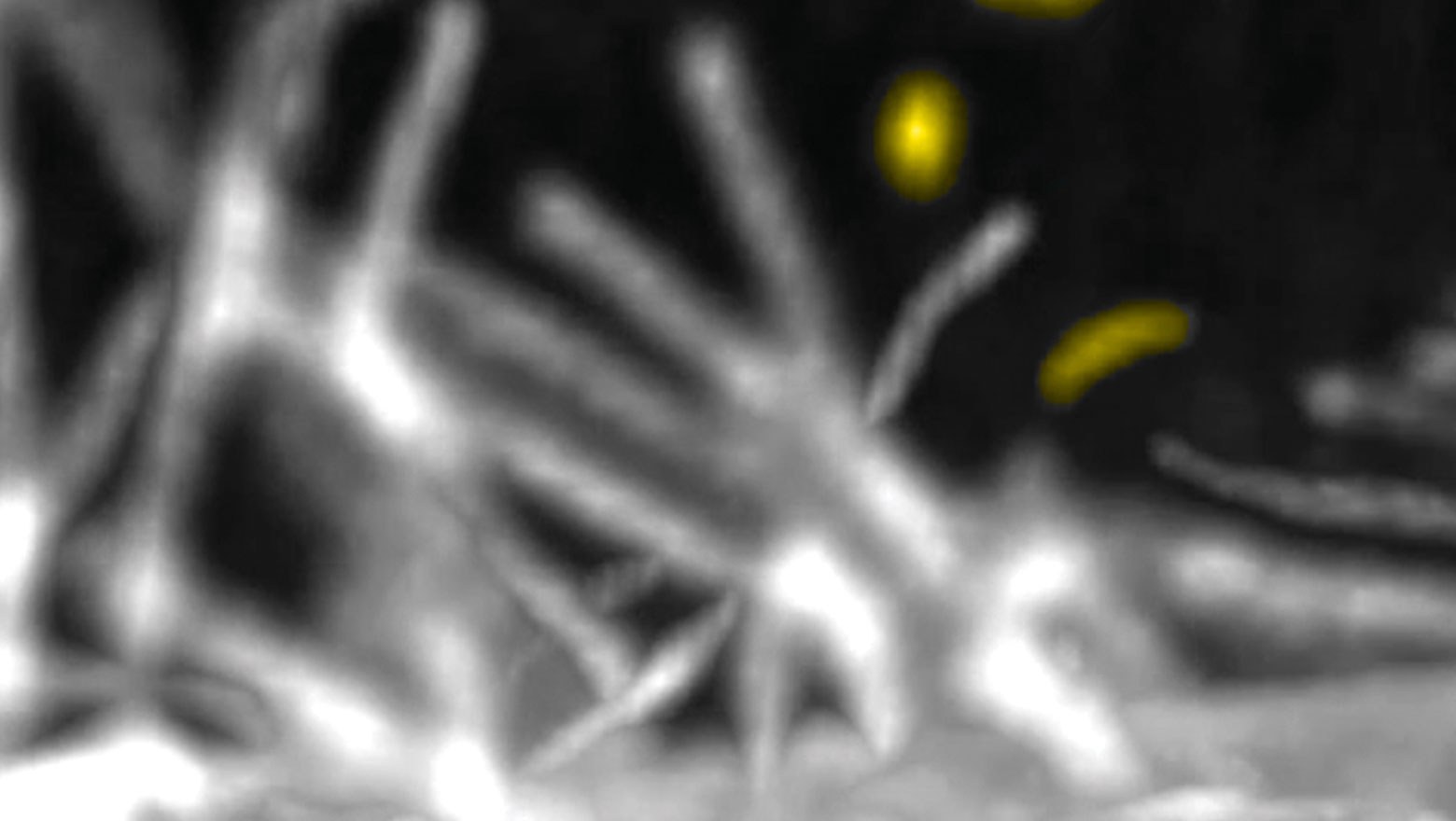
Single-nucleosome imaging uncovers biphasic chromatin dynamics in inducible human transformed cells
本研究は、ヒト細胞のがん化過程におけるクロマチンのふるまいが時間とともに再編成されることを1分子ヌクレオソームレベルで示しました。
-
CSF論文発表のお知らせ
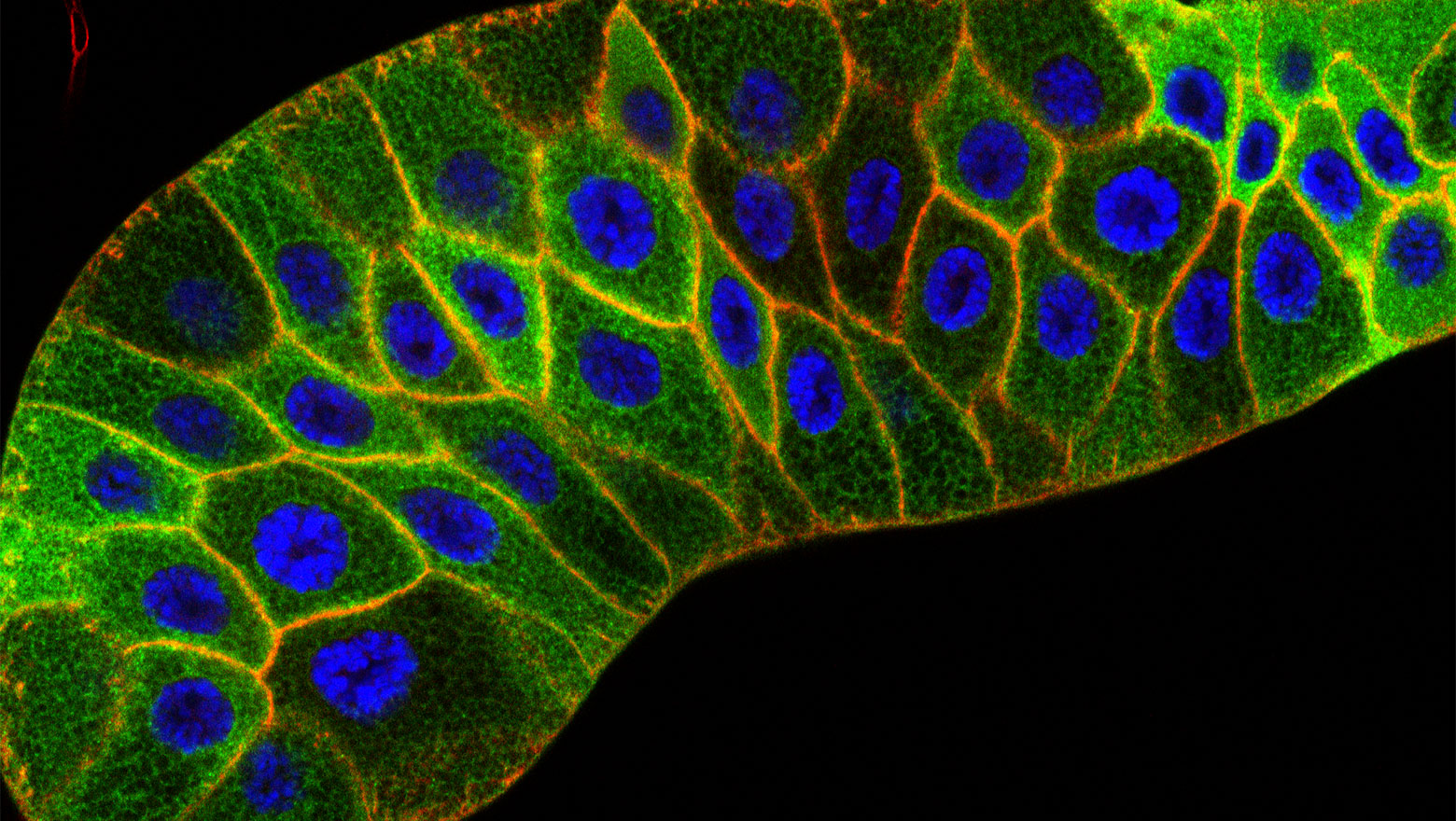
Structural truncation of IL-1R2 enhances the anti-inflammatory activity of HeLa cells
この論文では、IL-1R2の構造欠失が可溶化を促し、IL-1デコイ機能を増強することを示しました。
Journal
会報「細胞生物」
Events
学術大会・イベント
About
当学会について