生命科学を支える 細胞生物学
News / Topics
新着お知らせ
-
CSF論文発表のお知らせ
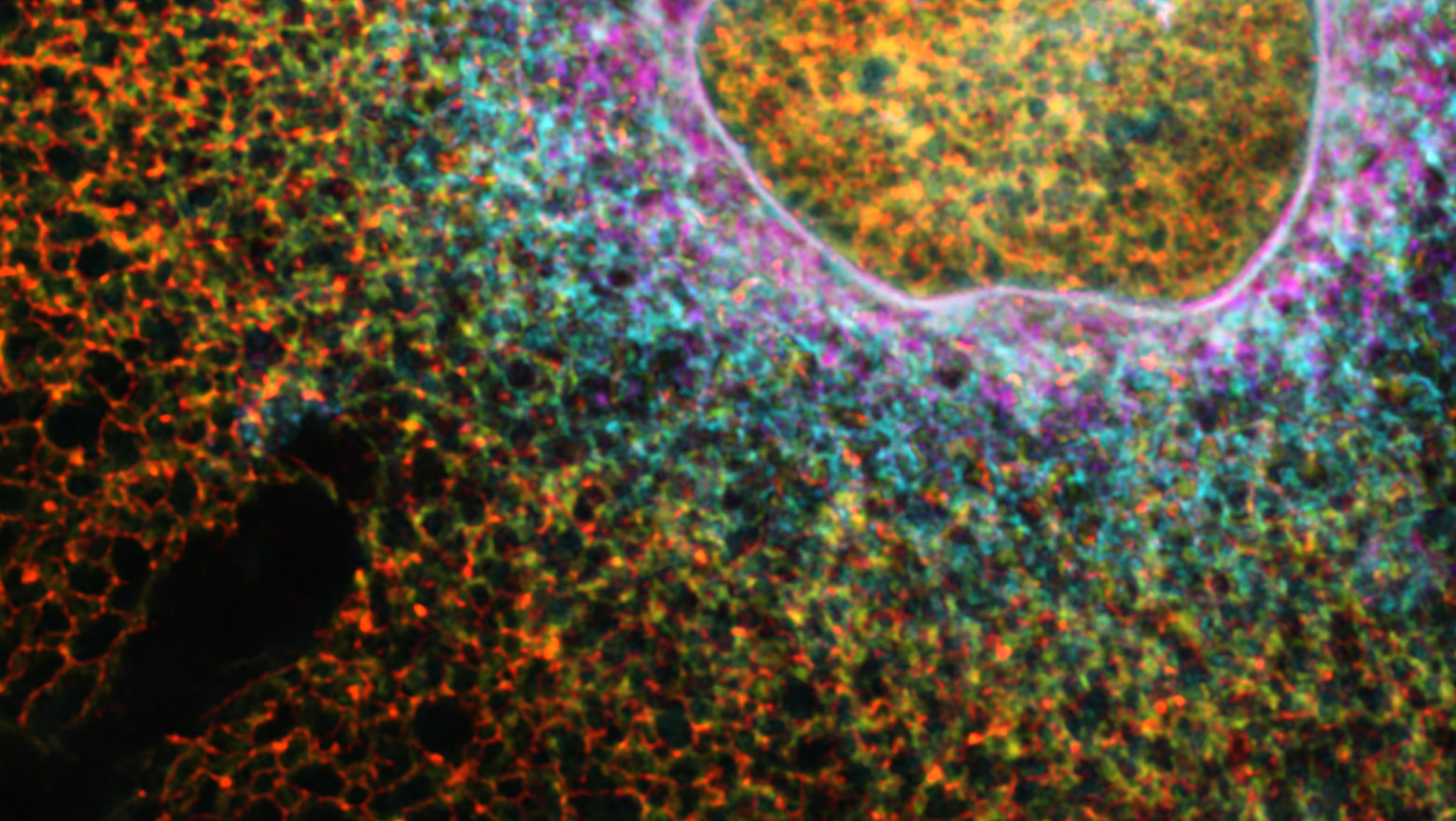
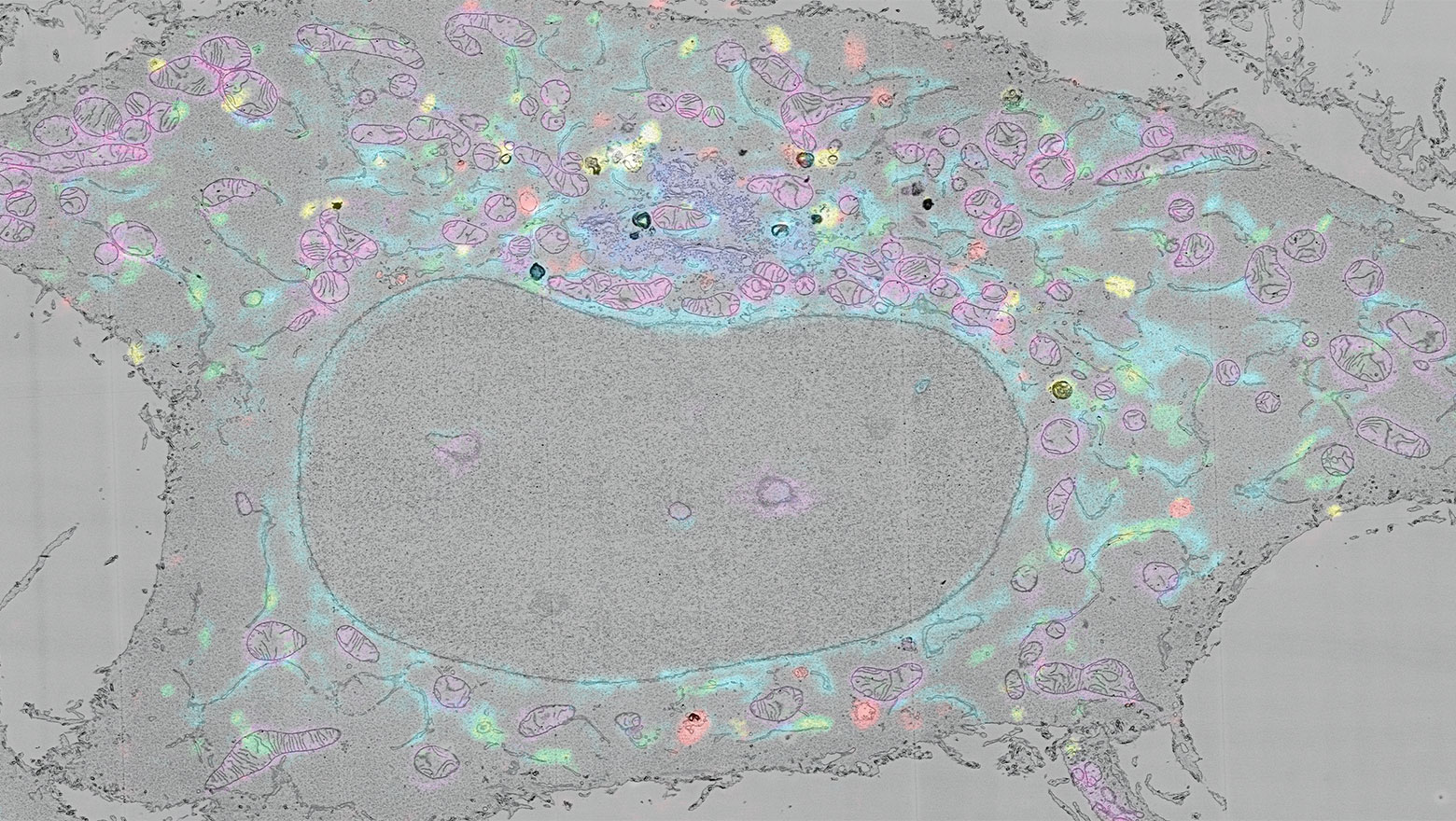
Deep Learning-Based Segmentation of 2D Projection-Derived Overlapping Prospore Membrane in Yeast
この論文では、重なり合った生体膜を正確に識別する深層学習モデルを開発し、出芽酵母が胞子形成時に生み出す前胞子膜の形態を定量的に解析しました。
-
CSF論文発表のお知らせ
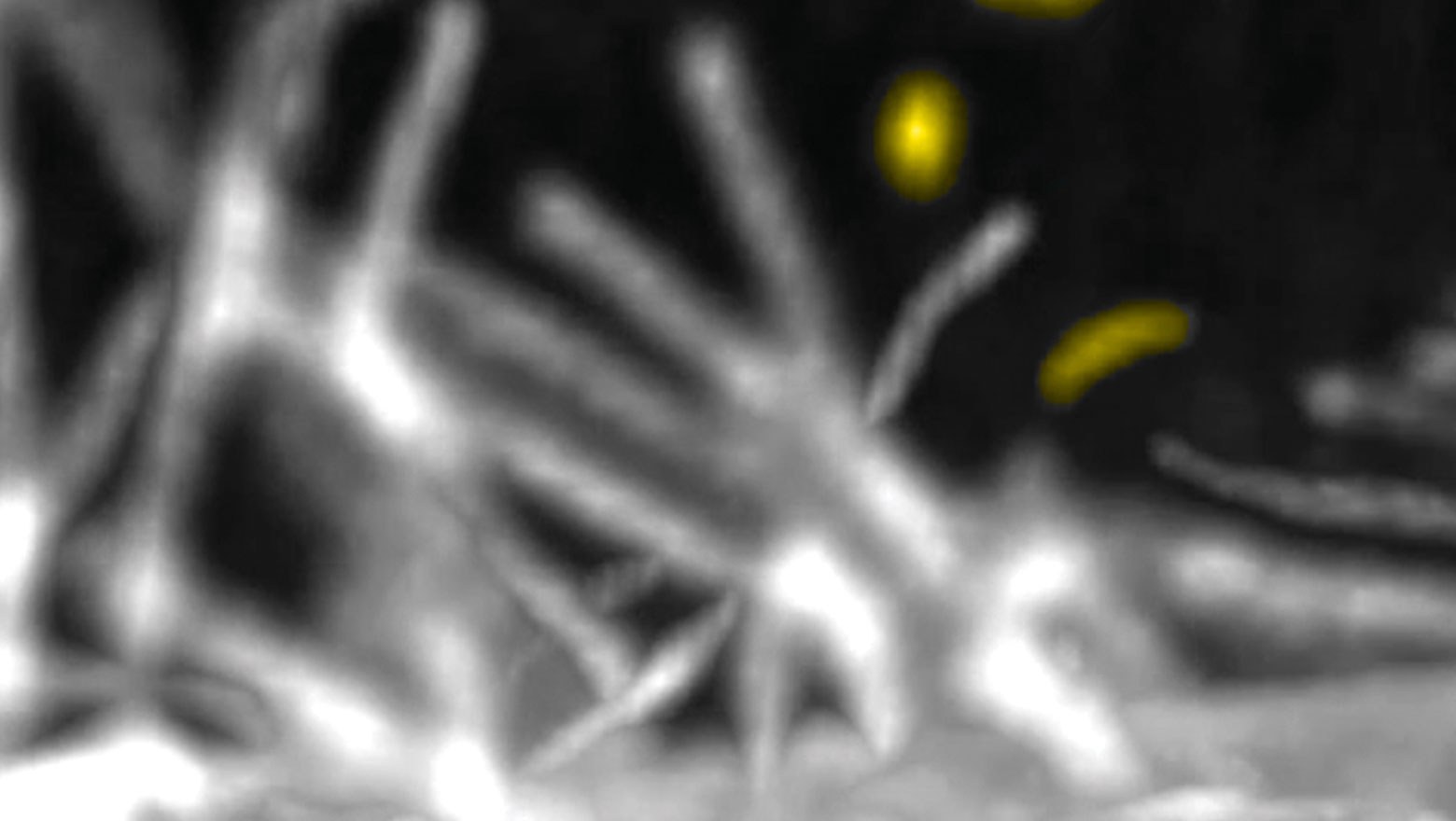
Supersulfides regulate cell migration in human skin keratinocytes
この論文は、皮膚角化細胞における超硫黄分子を可視化し、その細胞移動における役割を明らかにしました。
-
CSF論文発表のお知らせ
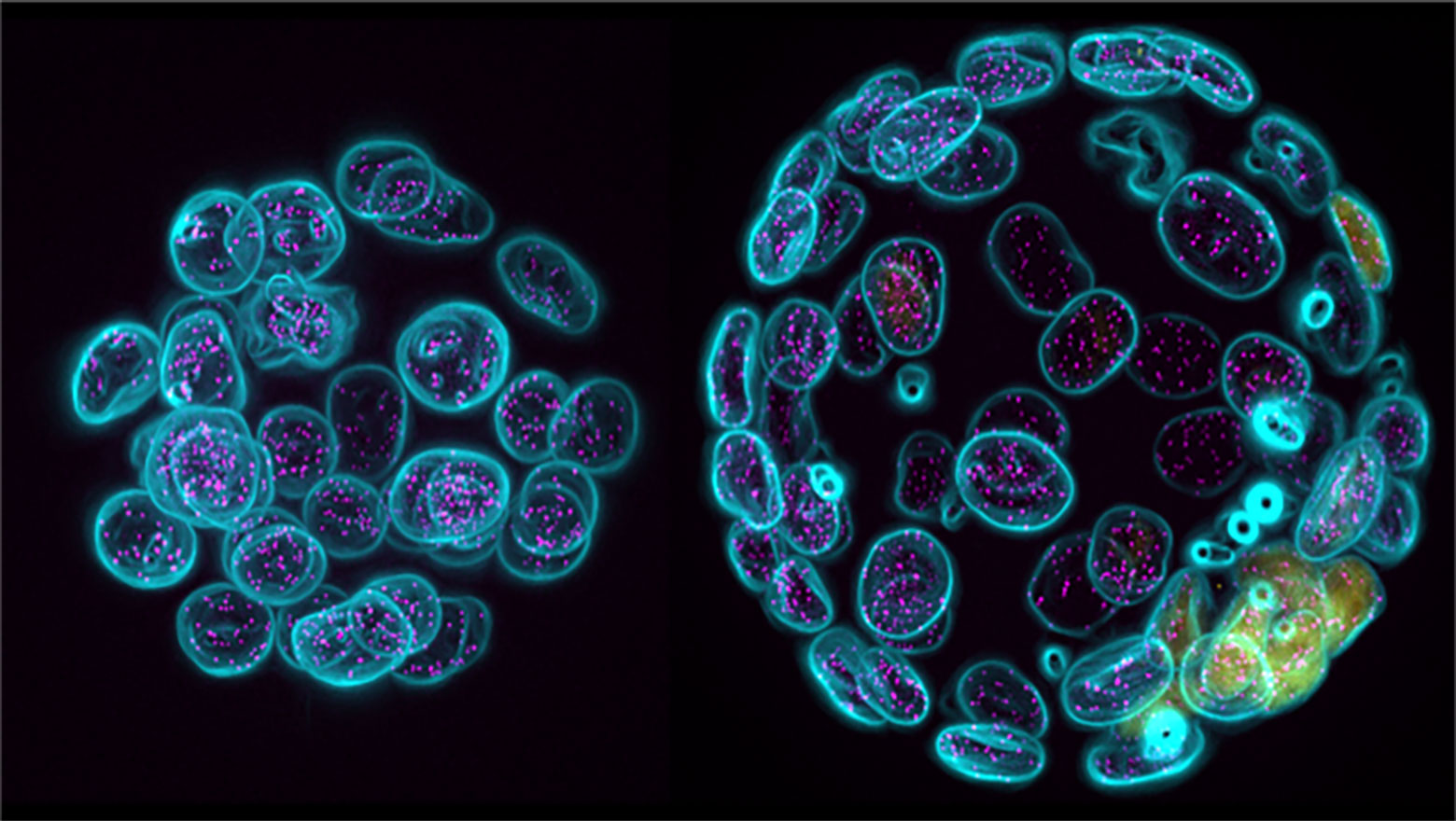
Assembly and mother centriole recruitment of IFT-B subcomplexes to form IFT-B holocomplex
この論文では、繊毛内タンパク質輸送を担うIFT-B複合体の母中心小体上での構築機構を明らかにしました。
-
CSF論文発表のお知らせ
Opto-p53: A Light-Controllable Activation of p53 Signaling Pathway
この論文では、がん抑制タンパク質p53の活性を光制御するツールを開発し、細胞周期停止や細胞死を誘導できることを示しました。
-
CSF論文発表のお知らせ
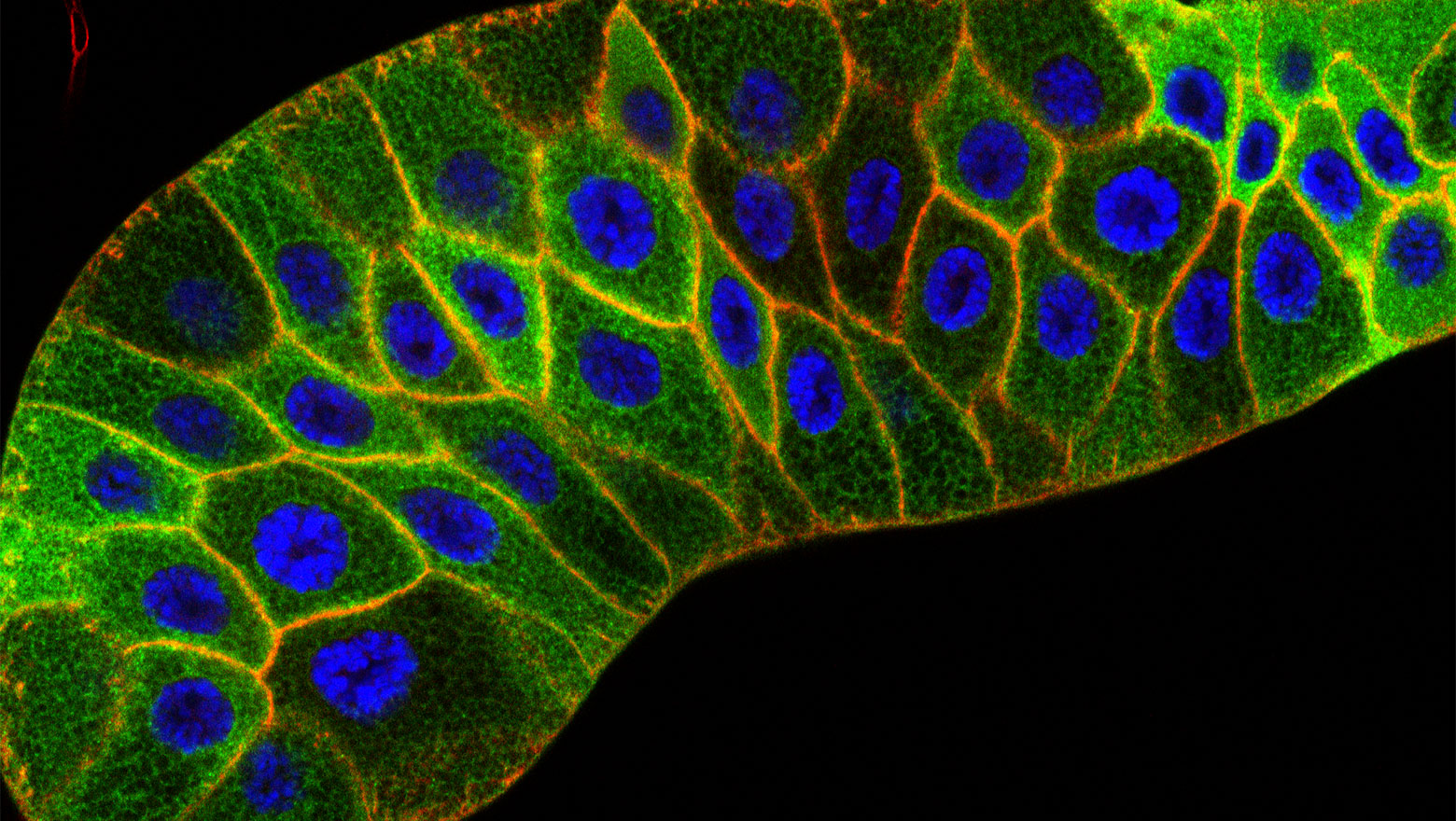
Cell biological insights into human STING variants
この論文は、自然免疫分子STINGのバリアントの機能と疾患との関連についてまとめた総説です。
Journal
会報「細胞生物」
最新巻頭言
Vol.36 July - August
愉しみ
Events
学術大会・イベント
About
当学会について