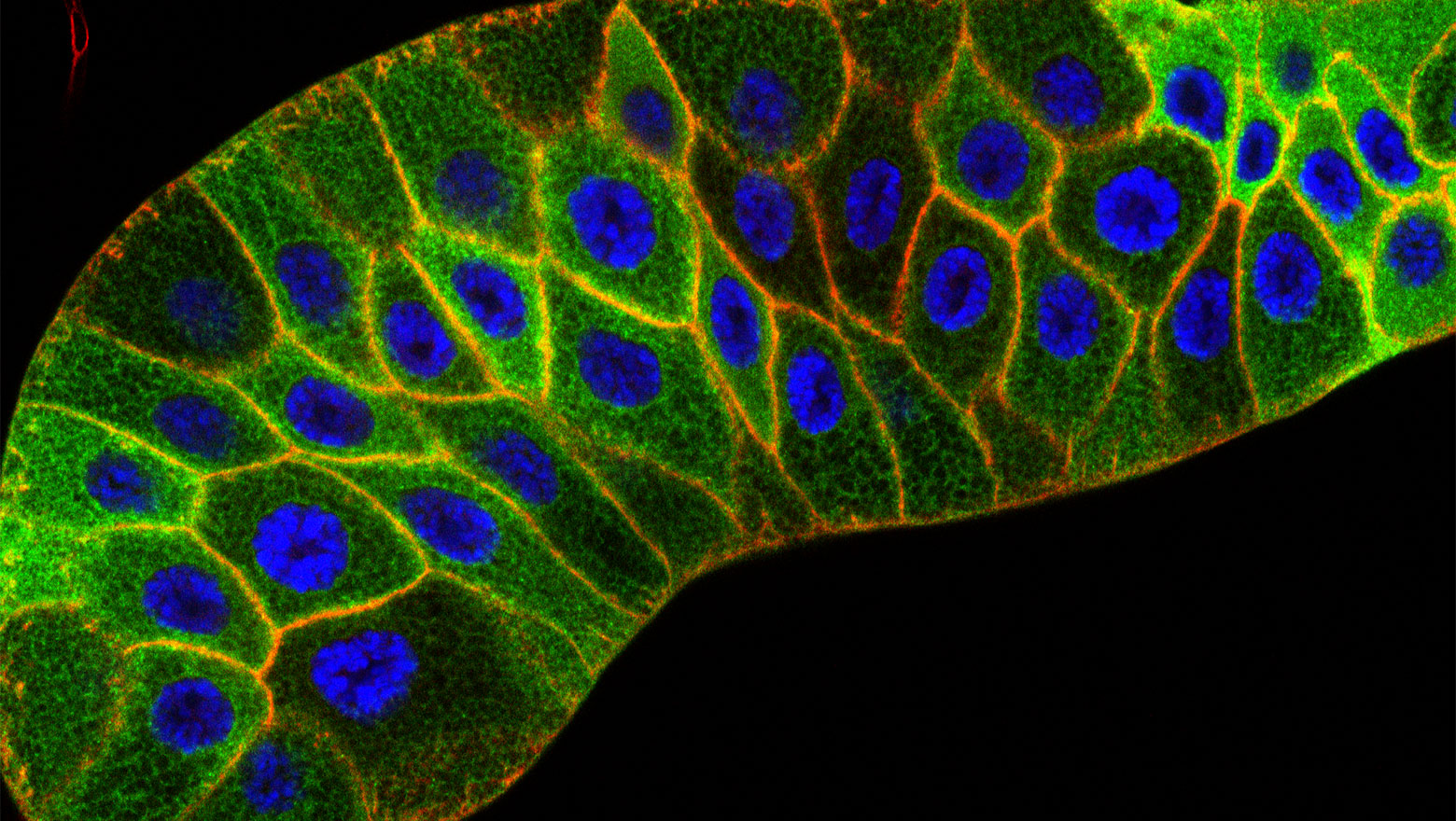
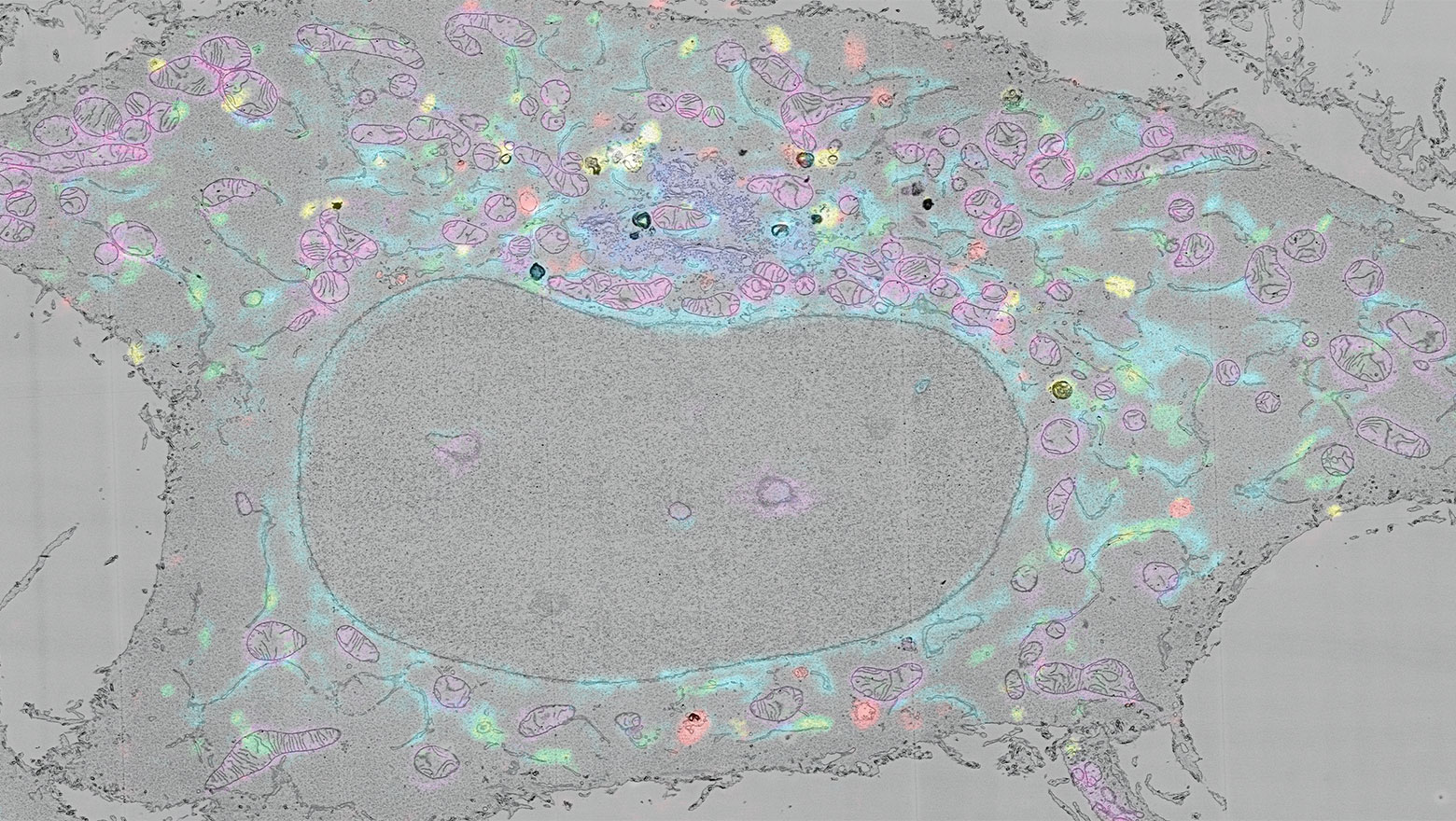
生命科学を支える 細胞生物学
News / Topics
新着お知らせ
-
CSF論文発表のお知らせ
A sensitive ERK fluorescent probe reveals the significance of minimal EGF-induced transcription
-
巻頭言
加納ふみ先生の巻頭言が掲載されました。
「カタチ」と「分子」をつなぐもの
-
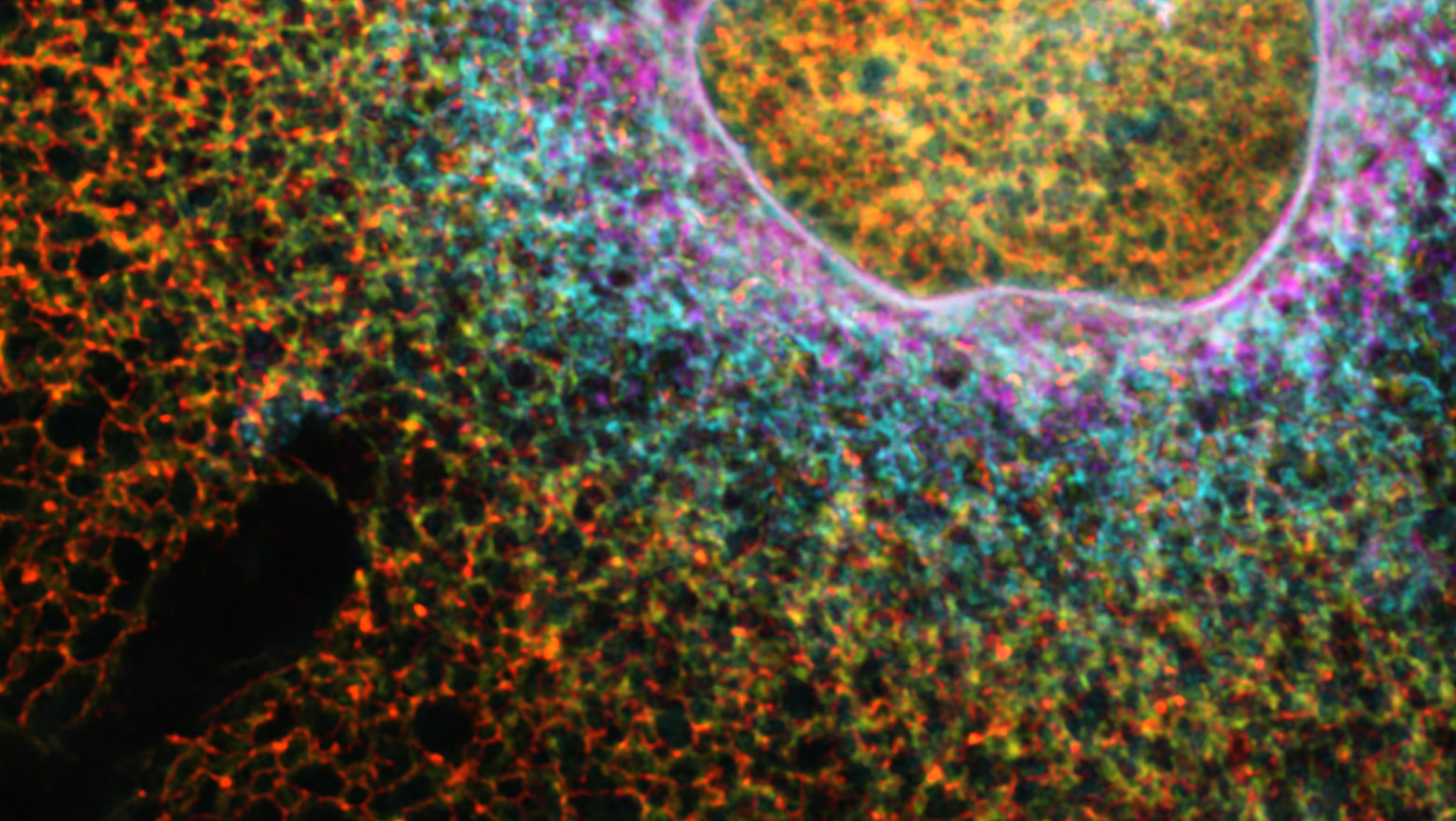
CSF論文発表のお知らせ
Multi-color fluorescence live-cell imaging in Dictyostelium discoideum
この論文では、細胞性粘菌において最大5色の生細胞蛍光イメージングの確立を報告しました。
-
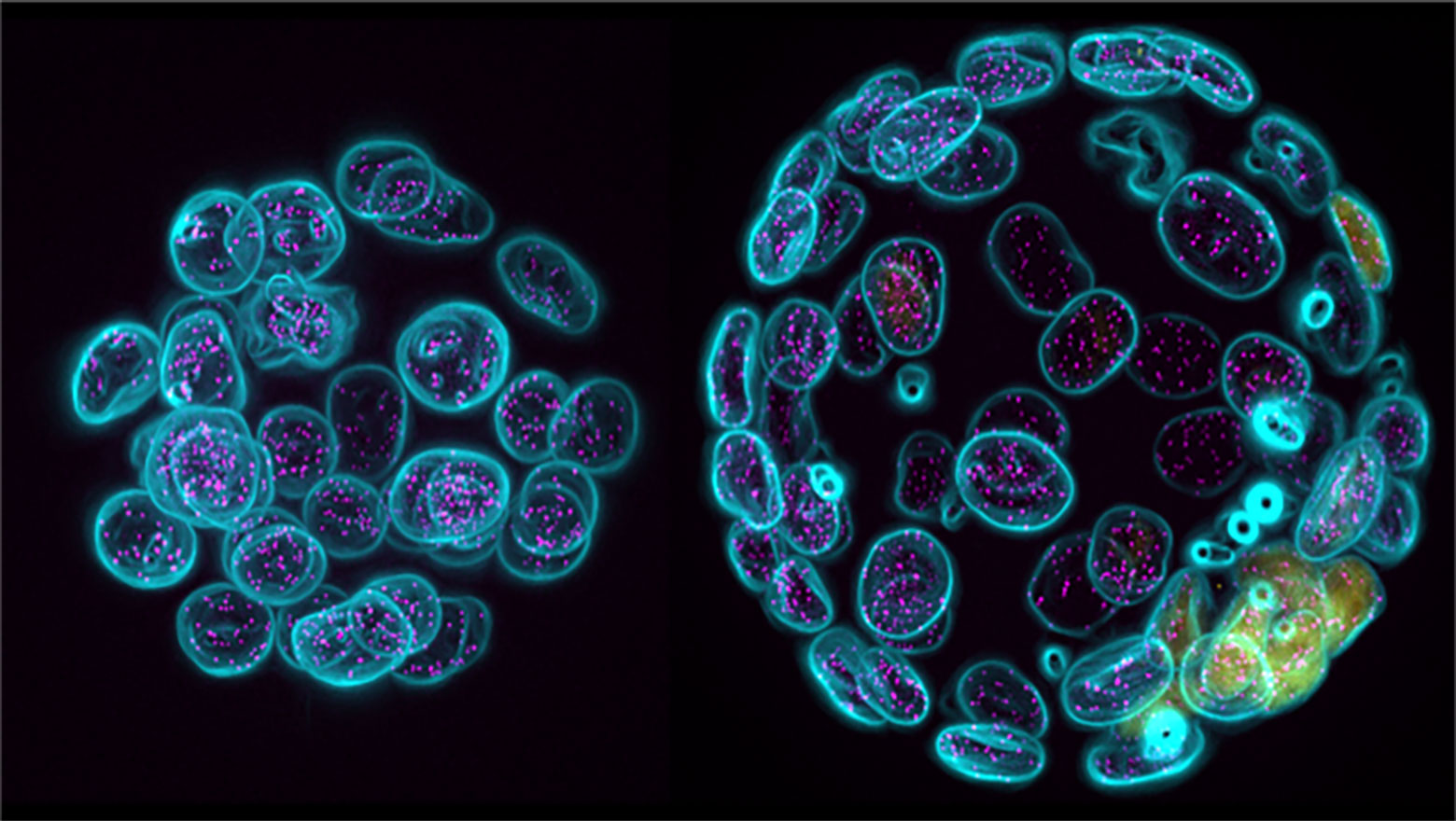
CSF論文発表のお知らせ
Possible roles of CAHS proteins form Tardigrade in osmotic stress tolerance in mammalian cells
この論文では、ヨコヅナクマムシのCAHSタンパク質をHeLa細胞に発現させ、高浸透圧刺激による凝集体形成やその耐性を調べました。
-
巻頭言
清川悦子先生の巻頭言が掲載されました。
「向いているとかいないとか」
Journal
会報「細胞生物」
Events
学術大会・イベント
About
当学会について