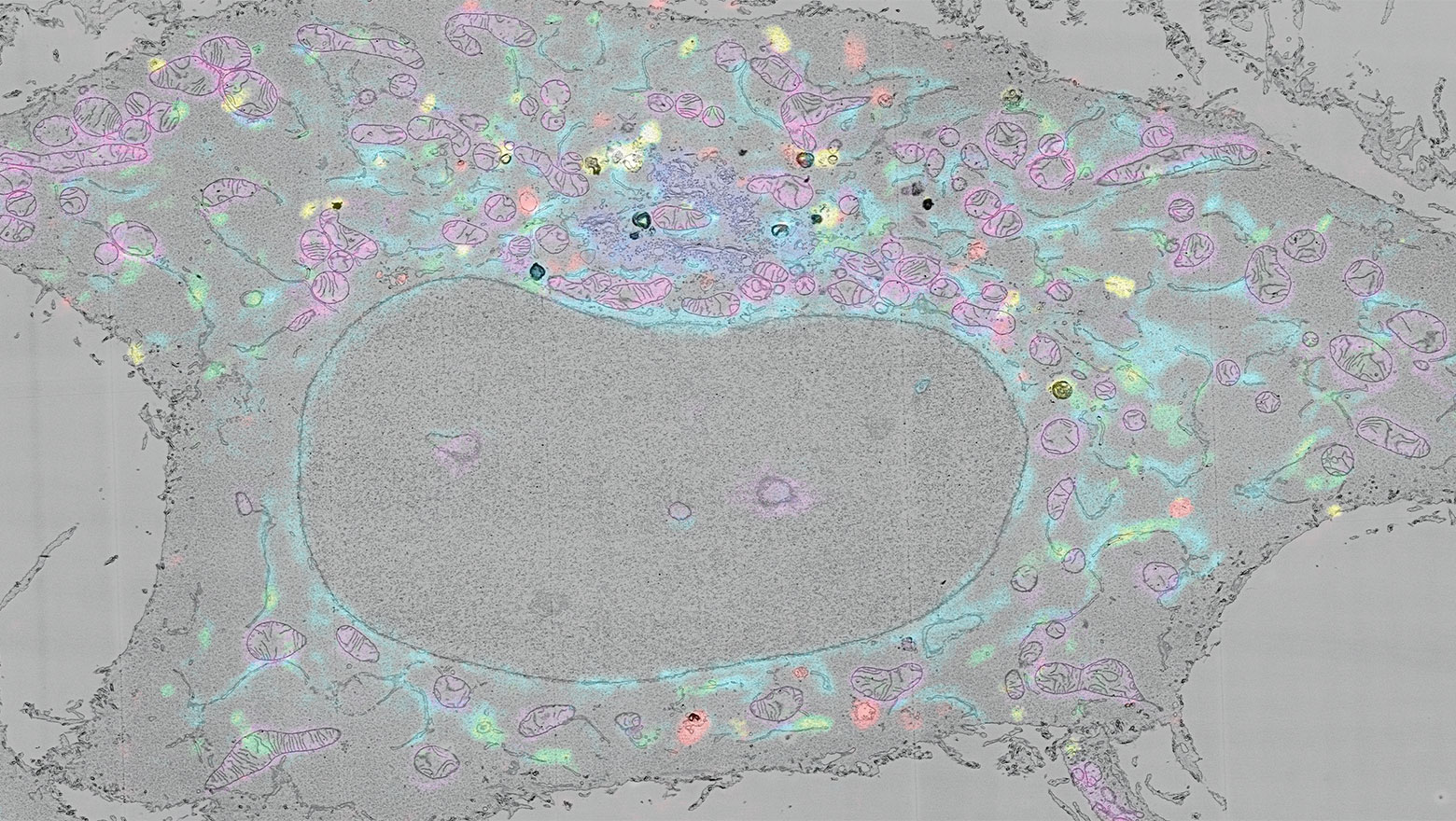
生命科学を支える 細胞生物学
News / Topics
新着お知らせ
-
CSF論文発表のお知らせ
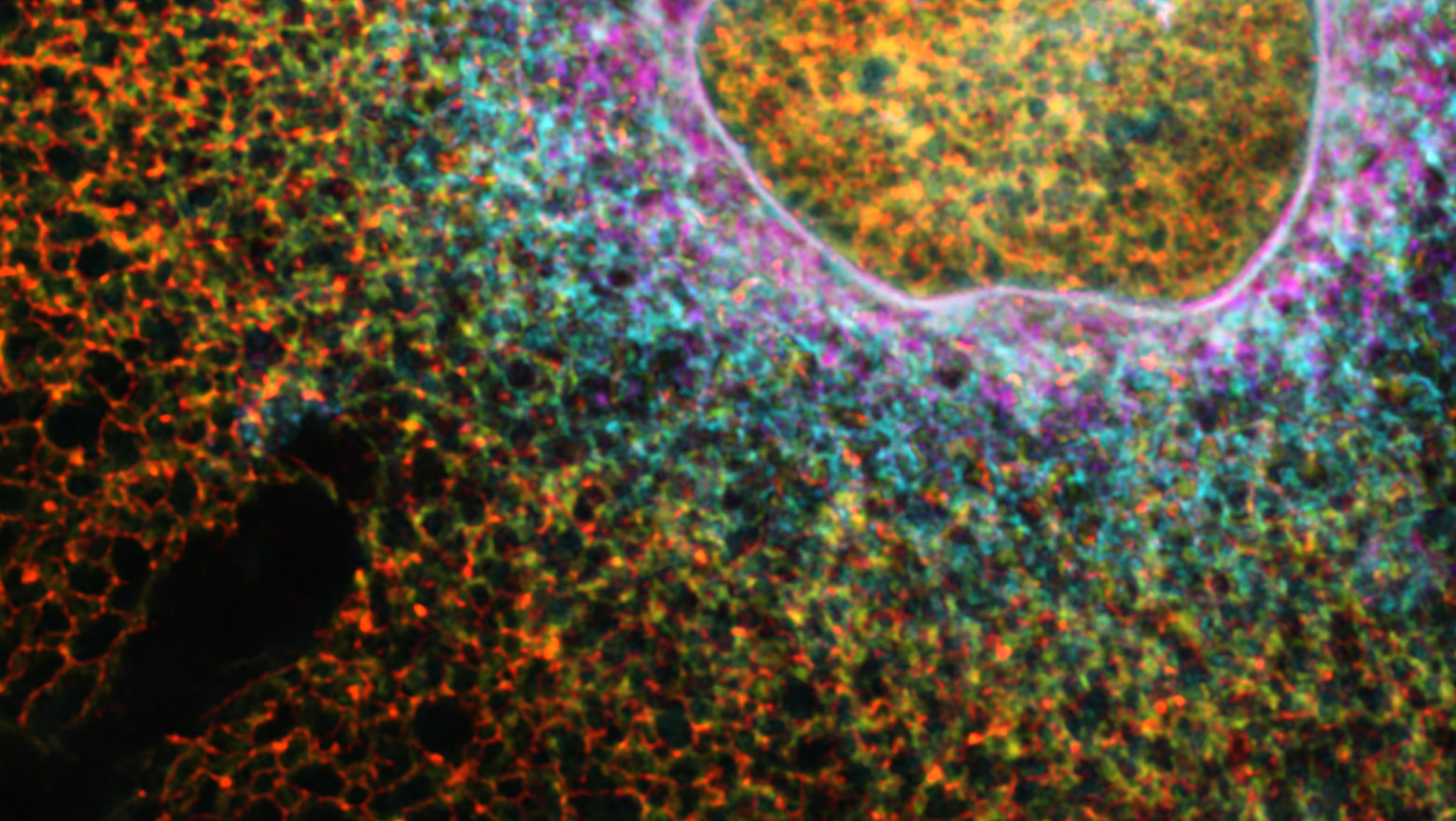
Structural truncation of IL-1R2 enhances the anti-inflammatory activity of HeLa cells
この論文では、IL-1R2の構造欠失が可溶化を促し、IL-1デコイ機能を増強することを示しました。
-
CSF論文発表のお知らせ
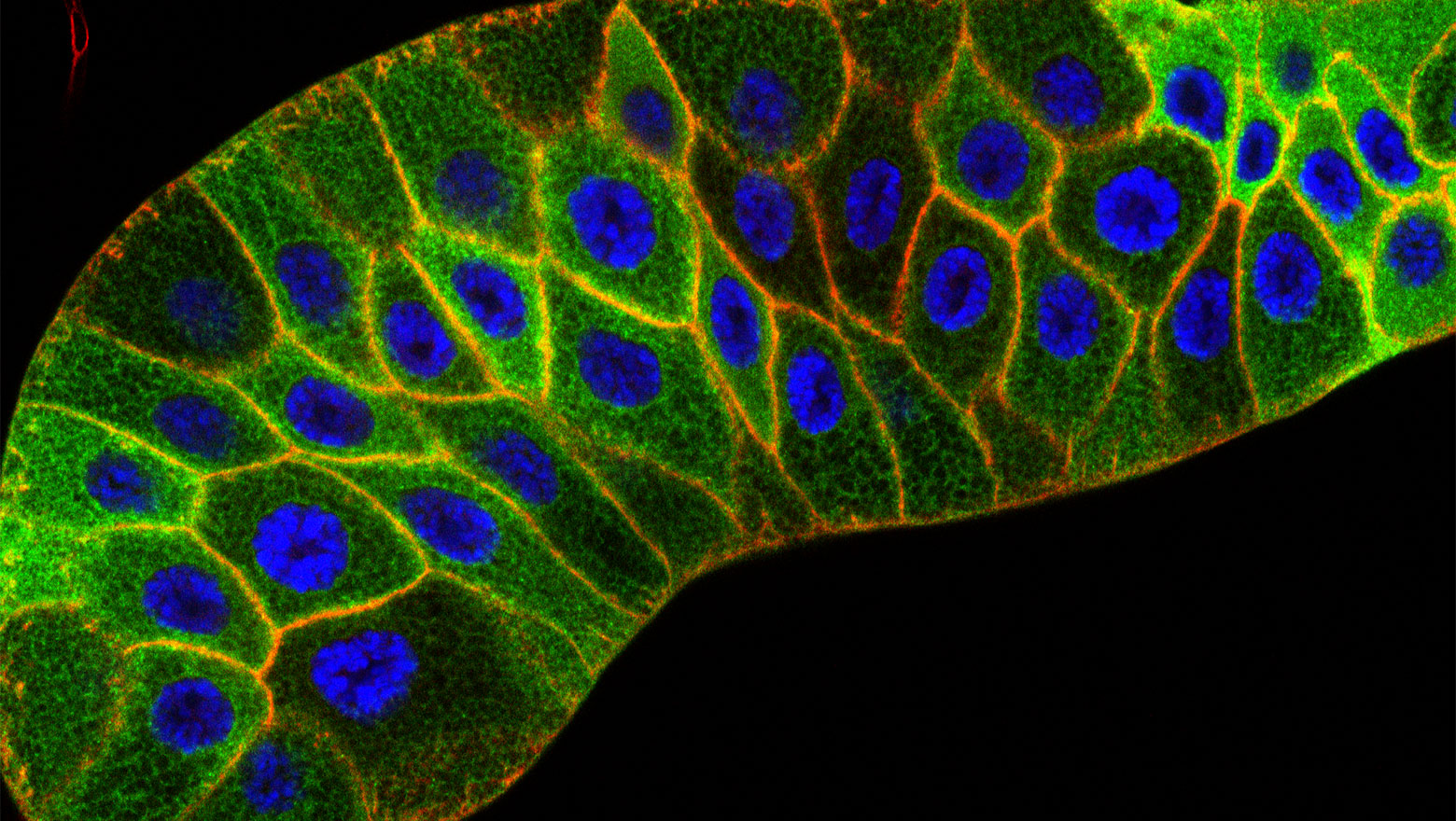
Context-dependent interactions among afadin, ZO-1, and actin filaments
この論文は、アクチン結合性足場タンパク質であるアファディンとZO-1の相互作用を、ジャンクションを持たない非上皮細胞を用いて明らかにしたものである。
-
CSF論文発表のお知らせ
Monitoring phospholipid dynamics in vivo with a fluorescent dye octadecyl rhodamine B
本論文では蛍光リン脂質プローブR18によるPE依存的なリン脂質動態と液胞-エンドソーム間のリン脂質輸送の可視化を報告する。
-
CSF論文発表のお知らせ
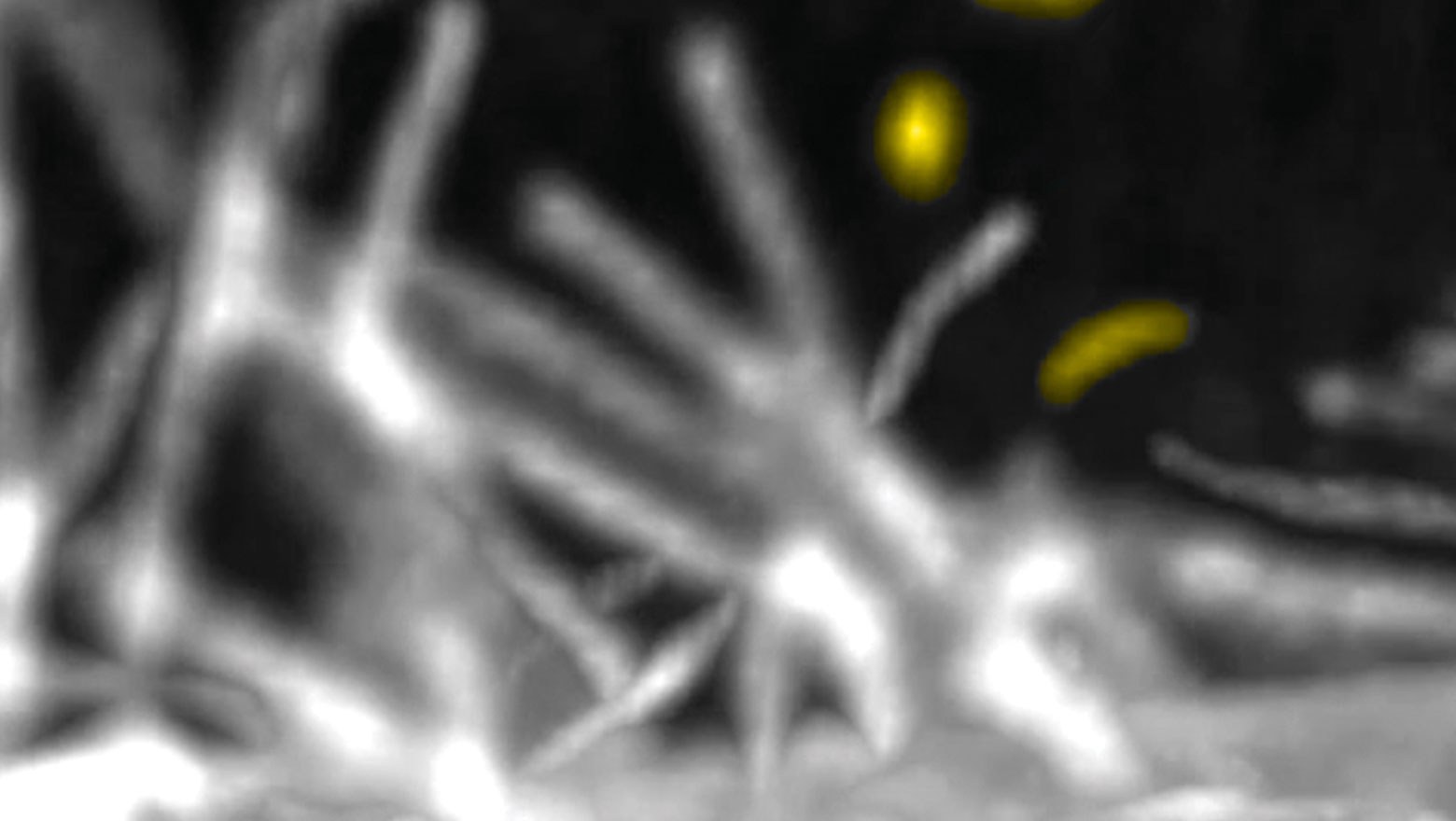
Extracellular presentation of syntaxin4 as a potential trigger for region-specific gastrulation
この論文では、初期胚におけるエピブラストの限られた領域で原腸陥入を誘導する非拡散性の候補因子について解析しました。
-
CSF論文発表のお知らせ
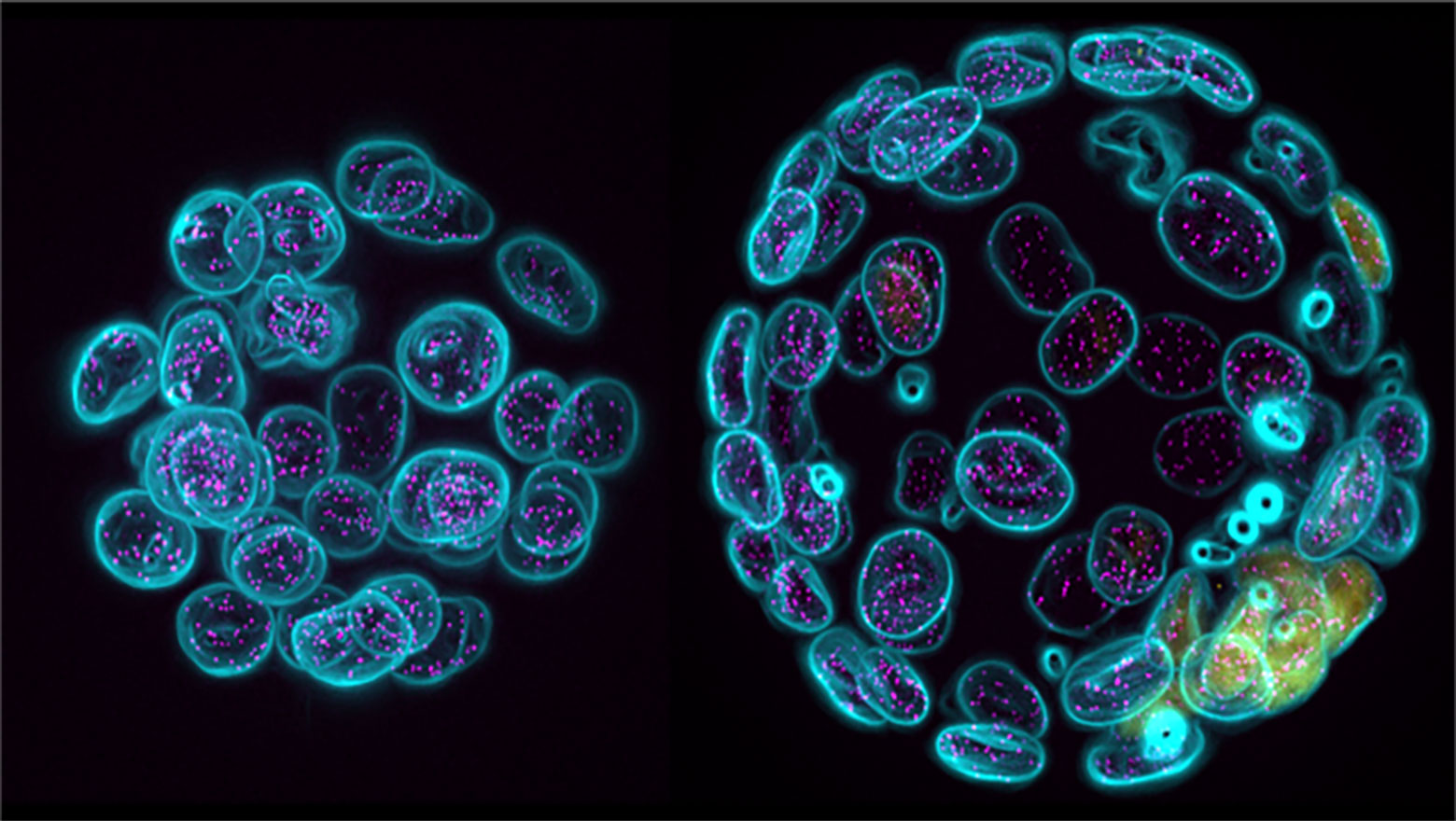
Deep Learning-Based Segmentation of 2D Projection-Derived Overlapping Prospore Membrane in Yeast
この論文では、重なり合った生体膜を正確に識別する深層学習モデルを開発し、出芽酵母が胞子形成時に生み出す前胞子膜の形態を定量的に解析しました。
Journal
会報「細胞生物」
Events
学術大会・イベント
About
当学会について