- ホーム
- >
- 細胞生物学用語集トップ
- >
- 新着細胞生物学用語集(%E7%B4%B0%E8%83%9E%E9%81%8B%E5%8B%95%E9%96%A2%E9%80%A3)
新着細胞生物学用語集(%E7%B4%B0%E8%83%9E%E9%81%8B%E5%8B%95%E9%96%A2%E9%80%A3)
| Rhoファミリー低分子量Gタンパク質による細胞骨格の制御 |
|---|
| 【Regulation of cytoskeletons by Rho family small GTPases】 |
| 遠藤 剛 |
| 千葉大学大学院理学研究科 |
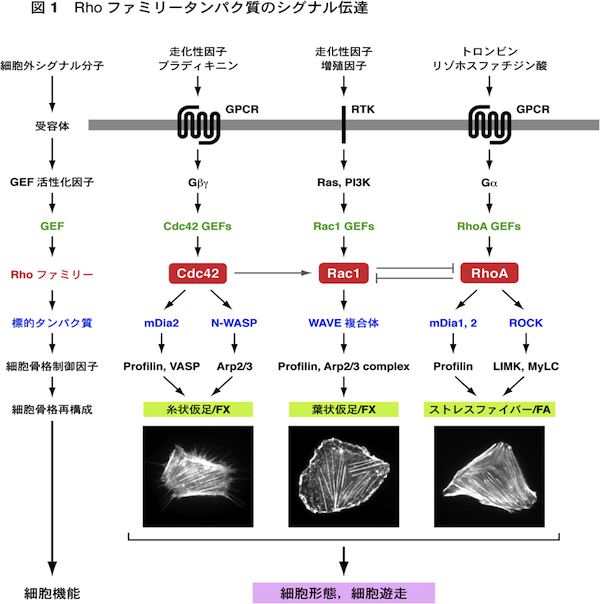
| 細胞内のアクチン細胞骨格と微小管はダイナミックに変化するが,その制御の中心的な役割を担っているのがRhoファミリー低分子量Gタンパク質である.哺乳類ではRhoファミリータンパク質は約20存在するが,これらのうちで特にRhoA, Rac1, Cdc42についての研究が進んでいる.これらはいずれも,細胞外のシグナル分子とそれらの受容体により活性化されたGDP/GTP交換因子(GEF)が作用して活性化される.すなわち,GDPを結合した不活性化状態からGTPを結合した活性化状態に変換される.活性化されたRhoファミリータンパク質は,標的タンパク質(エフェクタータンパク質)に結合して作用を現す.またGTPを結合したRhoファミリータンパク質にGTPase活性化タンパク質(GAP)が作用すると,GTPase活性が促進されてGTPを加水分解し,GDPを結合した不活性化状態にもどる. Cdc42は標的タンパク質のmDia2やN-WASPを介して,束状のアクチン線維を形成し,糸状仮足(filopodia)の形成を引き起こす.またRac1は標的タンパク質のWAVE複合体を介して,枝分かれしたアクチン線維のネットワークを形成し,葉状仮足(lamellipodia)の形成に働いている.RhoAは標的タンパク質のmDia1を介してアクチン線維を形成し,またROCK(Rhoキナーゼ)を介してアクチン・ミオシン相互作用を引き起こす.これによりストレスファイバーとフォーカルアドヒージョン(接着斑)の形成がもたらされる.走化性因子に向かって細胞が遊走する場合には,細胞前方(先導端)に形成される糸状仮足が走化性因子を含む細胞周辺の環境を探り,また葉状仮足が細胞体の移動に働く.さらにストレスファイバーが細胞後方(尾部)の退縮に働く.こうしてCdc42, Rac1, RhoAが時空的に協調して働くことにより,細胞遊走がもたらされる. 遊走している細胞は前方が広がった扇状の形態をとる.このような細胞では,核の前方に微小管形成中心(MTOC)が配置して,そこから微小管が伸長・短縮している(動的不安定性).微小管が伸長するプラス端は細胞前方に配向し,アクチン線維やフォーカルアドヒージョンに結合すると安定化する.Cdc42とRac1は標的タンパク質のPar6, IQGAP1, PAKを介して,核前方へのMTOCの配置,および微小管の安定化や細胞膜への結合に働く.またRhoAもmDia1, mDia2を介して微小管の安定化に働く.このようにCdc42, Rac1, RhoAは遊走細胞の極性(方向性)の形成にもかかわっている. 参考文献(1) 渡邊晴子,高野和儀,遠藤 剛 (2006) 蛋白質 核酸 酵素 増刊「細胞骨格と接着」,51, 683-692.
(2) Jaffe, A.B., Hall, A. (2005) Annu. Rev. Cell Dev. Biol. 21, 247-269. (3) Rottner, K., Stradal, T.E. (2011) Curr. Opin. Cell Biol. 23, 569-578. |
| ミオシンの局在制御機構と細胞運動 |
|---|
| 【Regulation of myosin II for subcellular localization and cell motility】 |
| 祐村 恵彦 |
| 山口大学大学院医学系研究科 |
ここでは,タイプIIのミオシンIIについてのみ解説する。このミオシンは骨格筋ミオシンに似ており,双極性の繊維を形成することができる。ミオシンIIは分裂細胞では,細胞質分裂時に収縮環に,移動細胞では細胞の尾部に局在する。ミオシンIIが局在する場所でアクチン繊維との相互作用により,力を発生し細胞質分裂,移動運動,さらに形態形成などに寄与していると考えられる。ミオシンIIの遺伝子を欠損させる実験が細胞性粘菌で初めて行なわれ,この欠損細胞では,収縮環依存の細胞質分裂ができないため,多核化することが示された。これ以前に,馬淵らによる,ミオシンに対する抗体を顕微注射すると細胞質分裂が阻害されるという歴史的実験もミオシンIIが細胞内で局在してその場所で力を出すことを示している。ミオシンII欠損細胞でも移動運動は可能であるが,尾部の収縮ができず,仮足でのアクチンの重合による伸長のみにより移動運動することになり速度も遅くなる。ミオシン繊維の形成はミオシンIIの細胞内局在には必須で,繊維化できない改変ミオシンでは局在が見られなくなる。ミオシンIIの繊維の制御と酵素の活性化の制御はリン酸化に依存するが,その修飾は生物によって軽鎖もしくは重鎖,もしくは両方が関与する。ミオシンIIが収縮環や細胞尾部にどのように局在するかは,まだよく分かってない。リン酸化の酵素活性が細胞内で偏っておれば,繊維を局所に集合させることができるという考え(リン酸化勾配説),アクチンを含めた細胞膜の流れがミオシンIIを分裂面や細胞尾部に運ぶ(表層流説),anillinのようなミオシンIIを分裂面にアンカーするタンパク質がある(結合タンパク質説)などが議論されている。最近,アクチン繊維が張力センサーとして機能していて,繊維が伸ばされる時にミオシンIIがより結合しやすくなるため,張力を発生し始めた部位にミオシンIIが集合するのではないかという斬新なアイデアが提唱されている。参考文献Mabuchi, I and M. Okuno (1977). The effect of myosin antibody on the division of starfish blastomeres. J Cell Biol. 74:251-263.
PubMed Uyeda T. Q. P. et al. (2011). Stretching actin filaments within cells enhances their affinity for the myosin II motor domain. PLoS One, e26200. PubMed Yumura, S. et al. (2008). Multiple mechanisms for accumulation of myosin II filaments at the equator during cytokinesis. Traffic, 9:2089-2099. PubMed |
| フィルギャップ |
|---|
| 【FilGAP】 |
| 太田 安隆 |
| 北里大学理学部生物科学科 |
| お問合せ |
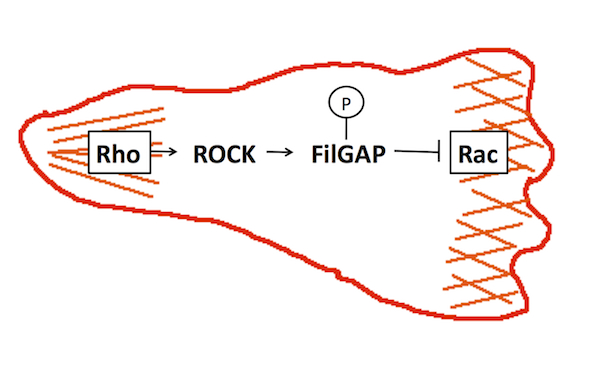
FilGAPは、低分子量GTP結合タンパク質 Racを特異的に不活化する因子GAP (GTPase-Activating Protein)の一つで、アクチン繊維架橋因子フィラミンに結合する。FilGAPを欠失した細胞は、細胞周囲に葉状仮足をランダムに進展させることからFilGPAは葉状仮足の形成制御に関与していると考えられる。FilGAPは、低分子量GTP結合タンパク質Rhoの標的タンパク質であるROCKキナーゼでリン酸化されると活性化される。細胞運動においては、Racが細胞の前部で活性化され葉状仮足を進展し、Rhoはミオシンを活性化し、収縮を促すことで細胞尾部を決定している。この細胞前部と尾部でのRacとRhoの特異的な活性化は、両者が互いに阻害し合っているからだと考えられており、FilGAPはRhoの下流でRacを不活化することで、RacとRhoの棲み分けに関与していると考えられる(図1)。FilGAPは、構造の似た他のRacGAPとファミリーを形成しており,メンバーとしてARHGAP22とARHGAP25が知られている。FilGAPの研究は北里大学理学部生体機能学講座のホームページに詳しく紹介されている。参考文献参考文献 Nat Cell Biol. 8:803-814, 2006 (PMID: 16862148) |
| 走化性とアクチン制御 |
|---|
| 【Chemotaxis and f-actin regulation】 |
| 上村 陽一郎・上田 昌宏 |
| 理化学研究所 神戸研究所 生命システム研究センター(QBiC) |
| お問合せ |
走化性(あるいはケモタキシス、chemotaxis)とは、細胞が外界の化学物質の濃度勾配を認識して示す誘因あるいは忌避運動のことである。走化性は多くの生物現象で重要な役割をもち、例えば、胚発生、神経回路の形成、あるいはがん細胞の原発巣からの転移(metastasis)に走化性が利用されている。特に白血球(leukocyte)の一つである好中球(neutrophil)が走化性により炎症あるいは感染部位へ集まることが昔からよく知られている。走化性研究には上記の好中球や微生物である細胞性粘菌(Dictyostelium discoideum)が用いられており、これらの細胞は進化的に離れているものの、その分子機構はよく似ている。走化性物質(chemoattractantあるいはchemorepellant)は7回膜貫通のGタンパク質共役型受容体(G protein coupled receptor)により感知され、三量体Gタンパク質(trimeric G protein)を介して下流の細胞運動装置を制御する。細胞は運動方向に顕著な極性をもち、細胞の前方では盛んにアクチン重合(F-actin polymerization)がおこり、仮足(pseudopod)形成が促進される。一方、細胞の後方ではミオシンII(MyosinII)が局在し、収縮力(contractile force)を発生することで、方向性のある細胞運動を効率的に制御すると考えられる。アクチン重合が細胞前端で局所的に起こるしくみは断片的にしか明らかでないが、リン脂質の一つであるホスファチジルイノシトール三リン酸(phosphatidylinositol(3,4,5)trisphospate)がメディエーターとして重要であると考えられている。参考文献 |

 HOME
HOME